含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应。
歧化反应刚好与归中反应相反,一种元素的化合价向两边散开。
一、归中规律
⒈ 归中律
价态归中是指:高价态的化合价降低,低价态的化合价升高,但不可能低的最后升得比原来价态化合价还高。
归中反应中,若一种元素化合价有数种,任意价转换后不能超过(大于或小于)中间价,如-2,0,+1,+2,+5,那么-2价的元素只能转换为0或+1,+5价的元素只能转换为+2或+1,0价的元素只能转换为+1,+2价的元素只能转换为+1,即+1价在此反应中为中间价态,大于+1价的最多转化为+1价和原价之间的价,用区间表示为[+1,原价)小于+1价的最多转化为+1价和原价之间的价,用区间表示为(原价,+1]也就是任意价转换后不能超过(大于或小于)中间价可以根据此原则判断电子转移。即同种元素的不同价态反应遵循“可靠拢不相交”。
⒉ 邻位转化规律
发生氧化还原反应时元素的化合价升高或者降低到相邻的价态,比如S有-2,0,+4,+6价态,如果是0价参加反应时升高到临近的+4,降低到临近的-2。
⒊ 跳位转化规律
一般都满足邻位规律,但是如果遇到的是强氧化剂或强还原剂则会被氧化为高价态和还原为低价态。如-2价的S如果遇到一般的氧化剂,被氧化到0价;如果遇到强氧化剂,则可能被氧化到+6价。含不同价态同种元素的物质在发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”,不会出现交错现象。例如:
2Na2O2+2CO2=2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2。
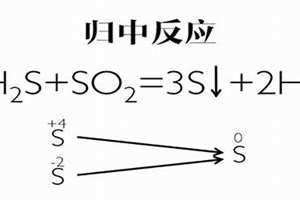
再如:2H2S+SO2=3S+2H2O
此反应中,H2S中的S是-2价,SO2中的S是+4价,它们两者发生氧化还原反应后,生成0价的S和水。
二、归中现象
⒈ 氧化还原反应中的归中反应
发生归中反应的条件是要符合中间价态理论:含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应。而且高低价态变化的结果是生成该元素的中间价态。
C+CO2=2CO
SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O
H2S+3H2SO4(浓)=4SO2+4H2O
Fe+2Fe3+=3Fe2+ (铁粉把铁离子还原为亚铁离子)
6HCl+KClO3=KCl+3Cl2↑+3H2O
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+2H2O
CuO+Cu=Cu2O
2Na+Na2O2=2Na2O
不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠拢或最多达到相同的价态,而决不会出现高价态变高、低价态变低的交叉现象。
利用中间价态理论可以解释为什么二氧化硫可用浓硫酸干燥(因为不存在+5价的硫)。
⒉ 复分解反应中的归中反应
复分解反应的归中反应是指碱与多元酸反应,正盐与对应的酸式盐或酸反应,酸与对应的酸式盐反应,其中的氢原子数出现的归中现象,从而生成一种酸式盐的一类反应。其中反映的归中规律正是酸式盐的形成条件。
⑴ 碱与多元酸反应
当多元酸过量时可形成酸式盐。
NaOH+H2S=NaHS+H2O;
H2SO4+NaOH=NaHSO4+H2O
⑵ 多元酸与对应的正盐反应
Na2S+H2S=2NaHS
CaCO3+H2O+CO2=Ca(HCO3)2
MgCO3+H2O+CO2=Mg(HCO3)2
Na2SO4+H2SO4=2NaHSO4
(NH4)2SO3+SO2+H2O=2NH4HSO3
Ca3(PO4)2+4HO4=3Ca(H2PO4)2
⑶ 多元酸与对应的酸式盐反应
Na2HPO4+HO4=2NaH2PO4
(4) 正盐与对应的酸式盐反应
NaH2PO4+NaO4=2Na2HPO4
如果把正盐和碱中所含的可电离的氢离子看成是零,那么,生成酸式盐的归中条件是:两种反应物组成上要相差两个或两个以上可电离的氢离子。
如果两种反应物的组成相差两个以上可电离的氢离子(即三元酸与对应正盐或与碱反应),则生成物与反应物用量有关,但符合“显强性”原理,即生成物的组成接近于过量物的组成。
如:磷酸与氢氧化钠反应(注:n表示物质的量)
n≤1,其反应为:
HO4+NaOH=NaH2PO4+H2O
n 在 1—2 之间,其反应为:
2HO4+3NaOH=NaH2PO4+Na2HPO4+3H2O
n=2,其反应为:
HO4+2NaOH=Na2HPO4+2H2O
n在2—3之间,其反应为:
2HO4+5NaOH=Na2HPO4+NaO4+5H2O
n≥3,其反应为:
HO4+3NaOH=NaO4+3H2O
又如:磷酸与磷酸钠反应
n≥2,其反应为:
2HO4+NaO4=3NaH2PO4
n=1,其反应为:
HO4+NaO4=NaH2PO4+Na2HPO4
n<1,其反应为:
HO4+2NaO4=3Na2HPO4
⒊ 双水解反应中的归中反应
这类归中反应是指能形成两性化合物的元素所形成的两类盐溶液反应形成氢氧化物的一类反应。这是金属阳离子和该金属所生成的阴离子生成中性的氢氧化物沉淀的归中现象。如:
Al3++3O2+6H2O=4Al(OH)3↓
Zn2++O2+2H2O=2Zn(OH)2↓
含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应。
歧化反应刚好与归中反应相反,一种元素的化合价向两边散开。
一、归中规律
⒈ 归中律
价态归中是指:高价态的化合价降低,低价态的化合价升高,但不可能低的最后升得比原来价态化合价还高。
归中反应中,若一种元素化合价有数种,任意价转换后不能超过(大于或小于)中间价,如-2,0,+1,+2,+5,那么-2价的元素只能转换为0或+1,+5价的元素只能转换为+2或+1,0价的元素只能转换为+1,+2价的元素只能转换为+1,即+1价在此反应中为中间价态,大于+1价的最多转化为+1价和原价之间的价,用区间表示为[+1,原价)小于+1价的最多转化为+1价和原价之间的价,用区间表示为(原价,+1]也就是任意价转换后不能超过(大于或小于)中间价可以根据此原则判断电子转移。即同种元素的不同价态反应遵循“可靠拢不相交”。
⒉ 邻位转化规律
发生氧化还原反应时元素的化合价升高或者降低到相邻的价态,比如S有-2,0,+4,+6价态,如果是0价参加反应时升高到临近的+4,降低到临近的-2。
⒊ 跳位转化规律
一般都满足邻位规律,但是如果遇到的是强氧化剂或强还原剂则会被氧化为高价态和还原为低价态。如-2价的S如果遇到一般的氧化剂,被氧化到0价;如果遇到强氧化剂,则可能被氧化到+6价。含不同价态同种元素的物质在发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”,不会出现交错现象。例如:
2Na2O2+2CO2=2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2。
再如:2H2S+SO2=3S+2H2O
此反应中,H2S中的S是-2价,SO2中的S是+4价,它们两者发生氧化还原反应后,生成0价的S和水。
二、归中现象
⒈ 氧化还原反应中的归中反应
发生归中反应的条件是要符合中间价态理论:含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应。而且高低价态变化的结果是生成该元素的中间价态。
C+CO2=2CO
SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O
H2S+3H2SO4(浓)=4SO2+4H2O
Fe+2Fe3+=3Fe2+ (铁粉把铁离子还原为亚铁离子)
6HCl+KClO3=KCl+3Cl2↑+3H2O
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+2H2O
CuO+Cu=Cu2O
2Na+Na2O2=2Na2O
不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠拢或最多达到相同的价态,而决不会出现高价态变高、低价态变低的交叉现象。
利用中间价态理论可以解释为什么二氧化硫可用浓硫酸干燥(因为不存在+5价的硫)。
⒉ 复分解反应中的归中反应
复分解反应的归中反应是指碱与多元酸反应,正盐与对应的酸式盐或酸反应,酸与对应的酸式盐反应,其中的氢原子数出现的归中现象,从而生成一种酸式盐的一类反应。其中反映的归中规律正是酸式盐的形成条件。
⑴ 碱与多元酸反应
当多元酸过量时可形成酸式盐。
NaOH+H2S=NaHS+H2O;
H2SO4+NaOH=NaHSO4+H2O
⑵ 多元酸与对应的正盐反应
Na2S+H2S=2NaHS
CaCO3+H2O+CO2=Ca(HCO3)2
MgCO3+H2O+CO2=Mg(HCO3)2
Na2SO4+H2SO4=2NaHSO4
(NH4)2SO3+SO2+H2O=2NH4HSO3
Ca3(PO4)2+4HO4=3Ca(H2PO4)2
⑶ 多元酸与对应的酸式盐反应
Na2HPO4+HO4=2NaH2PO4
(4) 正盐与对应的酸式盐反应
NaH2PO4+NaO4=2Na2HPO4
如果把正盐和碱中所含的可电离的氢离子看成是零,那么,生成酸式盐的归中条件是:两种反应物组成上要相差两个或两个以上可电离的氢离子。
如果两种反应物的组成相差两个以上可电离的氢离子(即三元酸与对应正盐或与碱反应),则生成物与反应物用量有关,但符合“显强性”原理,即生成物的组成接近于过量物的组成。
如:磷酸与氢氧化钠反应(注:n表示物质的量)
n≤1,其反应为:
HO4+NaOH=NaH2PO4+H2O
n 在 1—2 之间,其反应为:
2HO4+3NaOH=NaH2PO4+Na2HPO4+3H2O
n=2,其反应为:
HO4+2NaOH=Na2HPO4+2H2O
n在2—3之间,其反应为:
2HO4+5NaOH=Na2HPO4+NaO4+5H2O
n≥3,其反应为:
HO4+3NaOH=NaO4+3H2O
又如:磷酸与磷酸钠反应
n≥2,其反应为:
2HO4+NaO4=3NaH2PO4
n=1,其反应为:
HO4+NaO4=NaH2PO4+Na2HPO4
n<1,其反应为:
HO4+2NaO4=3Na2HPO4
⒊ 双水解反应中的归中反应
这类归中反应是指能形成两性化合物的元素所形成的两类盐溶液反应形成氢氧化物的一类反应。这是金属阳离子和该金属所生成的阴离子生成中性的氢氧化物沉淀的归中现象。如:
Al3++3O2+6H2O=4Al(OH)3↓
Zn2++O2+2H2O=2Zn(OH)2↓
欢迎走进文言那些事。这个视频来学习以词多语中的归。这次故事的主角是周瑜。周嘟嘟,周瑜年少英才,小乔来归,绝配演。赌素劝孙权举东吴之力与曹操战后周瑜归,问祭于愚于一人,东吴胜。曹操归东吴师弟,民归如流水。孙玄以公论尚,愧于华巫,于辞之曰:左君多年,今权归君王,乃臣子本分也。君贤臣用力,民有所归,此之为大姓也。
故事里每一句都有一个龟字,但是读音也都有所不同,接下来就一一分析。
·书文解字说龟女嫁也,指出了龟的本意就是女子出嫁。诗经中祝贺年轻姑娘出嫁有约诗词于归一级世家,这里的龟就是出嫁的意思,意思是说这位姑娘要出嫁定能使家庭美满。原来龟的本意是这么美好。
·左边第一行:周瑜年少英才,小乔来龟,绝配演。这个龟就是指嫁给的意思,意思是说周瑜年纪轻轻富有才华,小乔嫁给了周瑜真是绝配。你知道了龟的本意是出嫁,那女子出嫁到夫家也回到了另一个家,所以龟也就有了回家、回去、返回的意思。
·左边第二行:赌素却孙权举东吴之力与曹操战后周瑜归,问祭于愚于一人,这个龟就是返回的意思。整个句子是说赌素却说孙权用全国的力量和曹操作战,后来周瑜返回了,孙权向周瑜询问计策,周瑜也是这么说。接着看成年女子出嫁后,她的归宿就是夫家了,所以又隐身出了归区归宿的动词意。
·左边第七行:君贤臣用力,民有所归,此之为大姓也。这里的归就是归宿了,这是说东吴君祖贤名,臣子用心辅佐,百姓能有自己的归宿是国家的大姓。我们现在知道了归有归区的意思,那用到百姓身上这个意思又可以升为归富、归顺、归享。
·左边第四行:民归如流水,这个归就是归富的意思,意思是说百姓像流水一样归富了东吴。前面说了归可以称为归富、归顺,那百姓归富了东吴也就意味着他们属于动物的人了,所以龟也就有了龟鼠属鱼的隐身意。
·左边第六行:鱼雌之曰左君多年,今权威君王乃臣子本分也。这个龟就是龟鼠的意思。句子的意思是说周瑜辞谢了华屋的赏赐,说辅佐君主多年,如今全力归属于您,这是我作为臣子的本分。现在我们知道了归有属于的意思,如果把属于别人东西还给别人,那就是归还的意思了,这也是归的最后一个动词意。
·左边第三行:东吴胜,曹操归东吴失地。这个归就是归还的意思,意思是说东吴赤壁之战获胜了,曹操归还了之前占领的东吴土地。当然还有大家熟悉的顽皮归尚,这个归也同样是归还的意思。
·现在说完了动词意,再来看归的另外两个特殊意思。通假意,因为出嫁还有把女子送给别人的意思,所以归又通会表示赠送。
·左边第五行:孙权以攻论赏会于华巫,这里的愧就是赠送的意思。整个句子是说孙权论功行赏将华丽的巫舍赠送给周瑜。
·第二个贵通会表示惭愧,秦弟子游说秦王失败后形容枯槁面目离黑,壮有桂色。意思是说苏秦脸色憔悴,面孔又黄又黑,有惭愧的神色。
好了,咱们把龟的事都讲完了,下面就一起来复习吧。龟的本意指女子出嫁由这个本意隐身出了相关的一些动词意。女子出嫁相当于回了另一个家,所以第一个引生意是回家、回去、返回。接着继续隐身可以指归屈、归宿、百姓。归附,归顺,归向。归的另一个动词意表示归属,属于。最后一个动词意是归还。
说完了动词意再来说归的通假意,它们分别通馈赠的馈和惭愧的愧。关于龟的那些事就说到这,下个视频要出现的是物,不见不散。
copyright © 2022 一生命运网 版权所有 辽ICP备2022007116号-4
法律声明:本站文章来自网友投稿,不代表本站观点,版权归原创者所有,如果侵犯了你的权益,请通知我们,我们会及时删除侵权内容!
