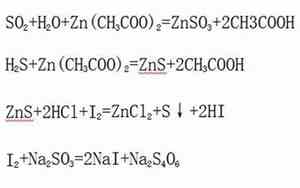
硫化氢(H2S)和二氧化硫(SO2)都是常见的硫化物,在某些化学反应中会发生交互作用。两者之间的反应主要取决于反应条件和产物的稳定性。
1. 碱性条件下的反应:
在碱性环境中,硫化氢与二氧化硫会发生反应,生成硫化钠(Na2S)和亚硫酸氢钠(NaHSO3),或者进一步生成硫代硫酸钠(Na2S2O3,硫代硫酸钠是沉淀):
```
H2S (aq) + SO2 (aq) + 2NaOH (aq) → Na2S (aq) + NaHSO3 (aq) + H2O (l)
```
或在溶液中反应生成硫代硫酸钠:
```
2H2S (aq) + SO2 (aq) + 2NaOH (aq) → Na2S2O3 (aq) + 2H2O (l)
```
2. 酸性条件下的反应:
在酸性条件下,两者反应生成硫和水,以及硫酸:
```
H2S (aq) + SO2 (aq) → S (s) + 2H2O (l)
```
这里,硫化氢和二氧化硫中的硫元素氧化态不同,H2S是-2价,SO2是+4价,在酸性环境下,可以看作是H2S为SO2提供电子,生成硫单质。
请注意,实际反应可能会因条件不同而有所变化,例如在有氧气存在的情况下,可能会形成硫和硫酸(H2SO4)。在处理这些化学物质时,安全起见,应严格遵守操作规程,佩戴好个人防护设备。
硫化氢(H2S)与二氧化硫(SO2)之间的反应条件对反应产物有很大影响。以下是两种主要反应条件:
1. 碱性条件:
在碱性环境中(如氢氧化钠或氢氧化钾存在),H2S和SO2会发生中和反应,生成硫化物和亚硫酸盐。例如:
```
H2S (aq) + SO2 (aq) + 2NaOH → Na2S (aq) + NaHSO3 (aq) + H2O
```
或者在某些情况下,进一步反应生成硫代硫酸钠(Na2S2O3):
```
2H2S (aq) + SO2 (aq) + 2NaOH → Na2S2O3 (aq) + 2H2O
```
这种反应通常发生在工业或实验室处理硫化物和硫氧化物时。
2. 酸性条件:
在酸性条件下(如硫酸或盐酸存在),H2S和SO2可以发生氧化还原反应,生成硫单质和水:
```
H2S (aq) + SO2 (aq) → S (s) + 2H2O
```
这种反应可能会产生刺激性气体和硫沉积,通常在氧化环境中观察到。
反应条件对于两种气体的反应路径至关重要。在实际操作中,必须根据具体目的和预期产物来调整环境条件。在处理这两种气体时,安全措施要尤其重视,因为它们可能有毒且具有腐蚀性。
硫化氢(H2S)与二氧化硫(SO2)反应的现象会根据反应条件和最终产物不同而有所不同。以下是几种可能的情况:
1. 碱性反应:
在碱性溶液中,当H2S和SO2混合时,首先会形成硫化钠(Na2S)和亚硫酸氢钠(NaHSO3),溶液可能会出现浑浊或者颜色变化,因为生成了无色或淡黄色的硫化钠。同时,由于反应不会立即停止,如果继续反应,还会生成硫代硫酸钠(Na2S2O3),这是一个透明的溶液。
2. 酸性反应(氧化还原反应):
在酸性环境中,两者会发生氧化还原反应生成硫,这个反应可能会产生刺激性的气体,因为H2S本身有恶臭,而被氧化生成的硫是无色或淡黄色固体,沉淀在溶液底部,溶液可能从无色变为浑浊。这种反应会产生放热现象,伴随着硫沉淀的可见变化。
3. 中和反应:
如果反应在中性或接近中性的溶液中进行,生成的硫化钠和亚硫酸钠是无色至白色固体,可能会沉降到溶液底部,导致溶液变浑浊。
无论哪种情况,由于H2S和SO2都有一定的毒性,反应过程中应尽可能在通风良好的地方进行,并使用适当的个人防护设备。此外,由于生成的硫单质和硫化物可能会造成环境污染,处理这些副产品时也需谨慎。
硫化氢与二氧化硫反应的双线桥表示法用来可视化电子转移,通常用于氧化还原反应。由于文字描述可能不直观,我将用文字描述一个可能的氧化还原过程(酸性环境):
H2S (aq) + SO2 (aq) → S (s) + 2H2O (l)
在双线桥表示法中,我们关注的是氧化态的改变。H2S中的硫原子开始是-2价,而SO2中的硫原子是+4价。在这个反应中,SO2是氧化剂,而H2S是还原剂。
```
H2S (aq) + SO2 (aq) → S (s) + 2H2O (l)
2 +40
|/|
H-S-O-S-O_2|
|| |
2- 0 4
```
在这个图中,从H2S的硫原子(-2价)向SO2的硫原子(+4价)的方向画出两条线,表示电子从H2S转移给了SO2,完成氧化还原过程。SO2的硫原子从+4价降为0价,生成单质硫,H2S的硫原子从-2价升高为0价,被氧化。
请注意,化学反应的实际电子转移可能会因环境条件不同而有所变化,上述示例仅是一个典型的酸性环境下的反应。在实际化学教学或实验室操作中,应遵循专业的指导和安全规程。
硫化氢(H2S)与二氧化硫(SO2)在不同反应条件下会产生不同的化学方程式。以下是两种典型的反应:
1. 在碱性条件下(例如在NaOH溶液中):
中和反应形成硫化钠(Na2S)和亚硫酸氢钠(NaHSO3):
```
H2S (aq) + SO2 (aq) + 2NaOH (aq) → Na2S (aq) + NaHSO3 (aq) + 2H2O (l)
```
或者进一步反应生成硫代硫酸钠(Na2S2O3):
```
2H2S (aq) + SO2 (aq) + 2NaOH (aq) → Na2S2O3 (aq) + 2H2O (l)
```
2. 在酸性条件下(例如在硫酸溶液或空气中存在氧气时):
发生氧化还原反应生成硫和水:
```
H2S (aq) + SO2 (aq) → S (s) + 2H2O (l)
```
注意:在碱性条件下,H2S会与SO2发生非氧化还原反应,而在酸性条件(尤其是有一定的氧化环境)下,H2S被氧化成硫,SO2则被还原为硫。这些反应都是放热反应,且涉及到硫化物和硫单质的生成,可能有刺激性气味。
硫化氢(H2S)与二氧化硫(SO2)在不同的反应条件下会产生不同的化学方程式。以下是一些常见的反应:
1. 碱性反应(生成硫化物和亚硫酸盐):
```
H2S (aq) + SO2 (g) + 2OH- (aq) → S2- (aq) + SO3^2- (aq) + 2H2O (l)
或
2H2S (aq) + SO2 (g) + 2OH- (aq) → S2O3^2- (aq) + 2H2O (l)
```
在这个反应中,H2S被硫酸根离子(SO4^2-)中和,SO2也被转化为亚硫酸根离子(SO3^2-)或硫代硫酸根离子(S2O3^2-)。
2. 酸性反应(氧化还原反应生成硫单质):
```
H2S (aq) + SO2 (g) → S (s) + 2H2O (l)
```
在酸性条件下,H2S是还原剂,SO2是氧化剂,反应生成硫单质。
这些反应通常取决于反应的进行环境(酸性或碱性)以及是否存在其他反应物,如氧气。在实际操作时,应根据具体条件确定反应方程式。同时,由于H2S和SO2都有一定的毒性,进行此类实验时必须采取适当的防护措施。
在硫化氢(H2S)和二氧化硫(SO2)反应中,化合价会发生变化。这对于氧化还原反应的理解非常重要。
1. 碱性反应(生成硫化物和亚硫酸盐):
在这个反应中,H2S中的硫元素(H2S → S2-)的氧化态从-2价升高为-2价,因为硫离子(S2-)的氧化态保持不变。SO2中的硫元素(SO2 → SO3^2- 或 S2O3^2-)被还原,从+4价降低为+4价(SO3^2-)或+2价(S2O3^2-)。
2. 酸性反应(氧化还原生成硫单质):
在酸性条件下,H2S中的硫元素被氧化,从-2价升到0价(生成单质硫S);而SO2中的硫元素被还原,从+4价降为0价。因此,H2S的硫元素从还原态变为氧化态,而SO2从氧化态变为还原态。
在这些反应中,H2S通常作为还原剂,提供电子,而SO2则作为氧化剂,接受电子。反应的具体热力学和产物取决于反应条件,如pH值和可能存在其他氧化剂或还原剂的影响。在处理这些化学物质时,需要注意它们的潜在危险性和对环境的影响。
copyright © 2025 一生命运网 版权所有 辽ICP备2022007116号-4
法律声明:本站文章来自网友投稿,不代表本站观点,版权归原创者所有,如果侵犯了你的权益,请通知我们,我们会及时删除侵权内容!
